Definición de Estructura de Lewis

M.C. en Ingeniería y Física Biomédicas
La estructura de Lewis es una notación gráfica utilizada en química que nos permite identificar los pares de electrones de valencia que poseen los átomos de los distintos elementos químicos. La estructura de Lewis nos permite identificar el número de electrones de valencia que tienen un átomo y representar los distintos enlaces químicos que se forman entre dos átomos.
El diagrama de puntos fue utilizado por primera vez por el químico estadounidense Gilbert Lewis en 1916, cuando en uno de sus artículos utilizó esta notación tan característica. A partir de ese entonces, la estructura de Lewis ha sido ampliamente utilizada en la química.
Principios con base en los electrones de valencia y la regla del octeto
Cuando los átomos interactúan entre sí para formar moléculas, solo entran en contacto sus regiones más externas. Un átomo se compone de un núcleo formado por protones y neutrones, y de electrones que se encuentran en orbitales atómicos bien definidos. Los electrones de un átomo se distribuyen en niveles energéticos, siendo el primer nivel el más cercano al núcleo y los niveles subsecuentes de mayor energía se van alejando del núcleo.
A los electrones que se encuentran en la capa más externa del átomo se les conoce como “electrones de valencia”. Los electrones de valencia son los que interactúan y los que participan en las reacciones químicas. El número de electrones de valencia que tiene un átomo depende de su número atómico, y, por ende, de su configuración electrónica.
Otro concepto importante que mencionar aquí es la “Regla del Octeto”. Los átomos de un elemento reaccionan y forman enlaces con otros átomos con el fin de alcanzar una configuración electrónica más estable. Los átomos que tienen 8 electrones de valencia son los más estables y no reaccionan, ejemplo de ello son los gases nobles. A esta estabilidad alcanzada con los 8 electrones de valencia es a lo que nos referimos con la regla del octeto. Cabe destacar que esta regla no aplica para el hidrógeno y el helio, los cuales alcanzan su configuración más estable con solo 2 electrones de valencia.
Ahora que ya hemos hablado sobre los electrones de valencia y la regla del octeto, estamos listos para hablar sobre la estructura de Lewis. Para dibujar la estructura de Lewis de un elemento químico se coloca el símbolo químico del elemento y alrededor de este se ponen los pares de electrones de valencia. Recordemos que los electrones se acomodan en pares dependiendo de su spin. Estos electrones se representan como puntos alrededor del símbolo químico del elemento. Por ejemplo, el oxígeno (O) tiene 6 electrones de valencia, por lo tanto, la estructura de Lewis del oxígeno se ve como:
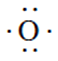
Donde cada punto corresponde a un electrón de valencia. Esta notación nos permite, primero, identificar el número de electrones de valencia que tiene un elemento, y por consiguiente, determinar el número de enlaces que puede tener con otros átomos para crear un compuesto químico. En segundo lugar, la estructura de Lewis nos permite representar de una manera gráfica los distintos tipos de enlaces químicos que existen.
Enlace iónico
El enlace iónico es un tipo de enlace químico que se da entre un elemento metálico y uno no metálico como consecuencia de la gran diferencia de electronegatividad que hay entre ambos. En este tipo de enlace uno de los átomos cede su electrón de valencia al otro con el fin de que este último complete su octeto. Esta transferencia de electrones hace que se forme un ion positivo y ion negativo que se mantendrán unidos por la interacción electrostática entre ambos.
Un ejemplo clásico de enlace iónico es el que existe entre el sodio (Na) y el Cloro (Cl) para formar cloruro de sodio (NaCl). Este enlace se puede representar con estructura de Lewis de la siguiente manera:

Enlace covalente
El enlace covalente se da entre dos elementos no metálicos cuya diferencia entre sus electronegatividades es nula o más pequeña que la existente entre los elementos que se unen por enlace iónico. En este tipo de enlace los electrones de ambos átomos se comparten entre sí para completar el octeto de los átomos participantes y que estos alcancen la estabilidad. La unión por medio de enlace covalente se da por los electrones que se comparten entre los átomos que lo forman.
Podemos mencionar el ejemplo de la molécula de hidrógeno (H2), la cual se forma por la unión de dos átomos de hidrógeno (H) por medio de un enlace covalente. La estructura de Lewis de este tipo de enlace se ve como:
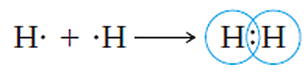
Donde el par de electrones que se ubica en medio de ambos símbolos del elemento químico son los que se comparten en el enlace covalente. Otra forma con la que se representa la estructura de Lewis de este tipo de enlace es la siguiente:
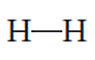
Donde la línea central indica que se formó un enlace covalente entre estos dos elementos. En los enlaces covalentes se pueden compartir más de dos electrones para unir dos elementos químicos, esto da lugar a compuestos que se forman por dobles o triples enlaces. Por ejemplo, la molécula de dióxido de carbono (CO2) se forma con dos dobles enlaces entre el átomo de carbono (C) y los dos átomos de oxígeno (O). Este enlace en estructura de Lewis se representa de la siguiente manera:
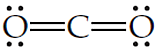
En este caso, cada línea representa un par de electrones compartido en un enlace covalente. Por otro lado, la molécula de nitrógeno (N2) se forma a través de un triple enlace covalente entre dos átomos de nitrógeno (N). Este triple enlace se puede representar con estructura de Lewis como:
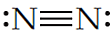
En este caso podemos darnos cuenta de que las tres líneas representan a los tres enlaces covalentes que se forman para generar esta molécula.

Trabajo publicado en: Jul., 2024.
Referencias
Chang R. (2010). Química (4° ed.). México: McGraw Hill.Brown T., LeMay E., Murphy C., Bursten B. & Woodward P. (2014). Química, La ciencia central (12a. ed.). México: Pearson Educación.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.